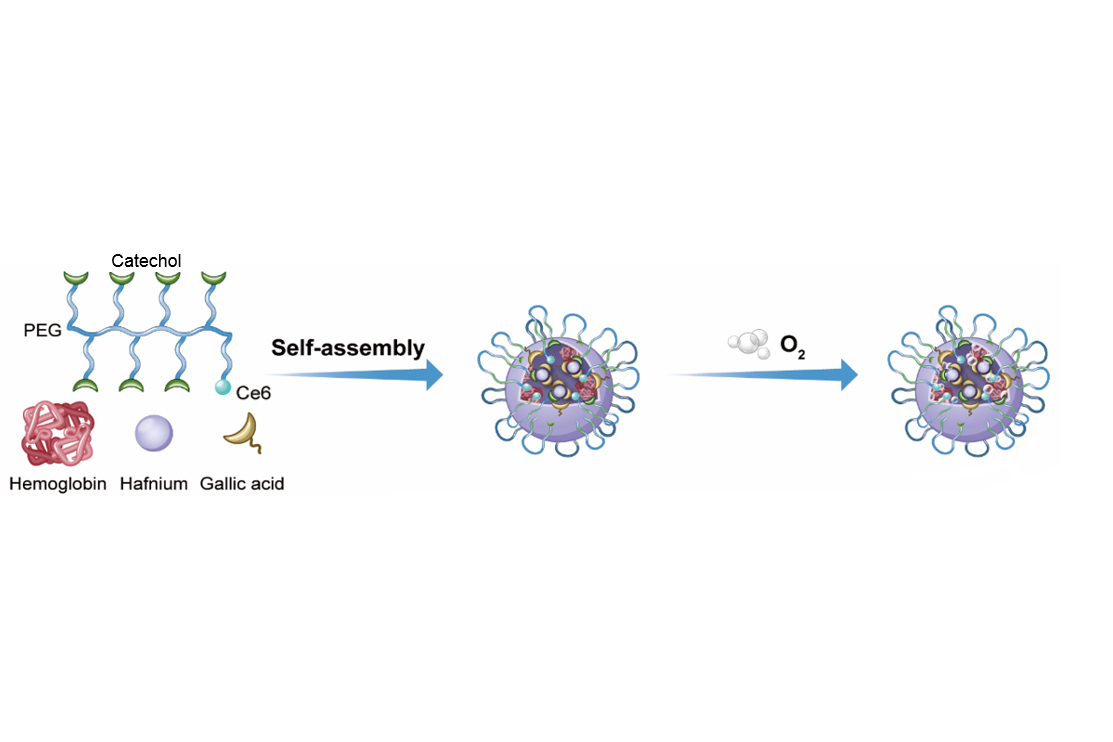
 金属多酚配位纳米倍增器的合成示意图
金属多酚配位纳米倍增器的合成示意图
澳门大学健康科学学院助理教授代云路带领的研究团队设计并合成了富氧金属多酚配位纳米倍增器,将放疗产生的离子化能量集中在肿瘤微环境,同时产生ROS诱导癌细胞损伤,能深层次强化抗肿瘤放疗的治疗效果。相关新型治疗策略已刊登于国际顶级学术期刊《先进科学》(Advanced Science)。
放射疗法(Radiotherapy)作为传统的癌症治疗手段,经过多年的实践验证,其功效已在各种类型的癌症治疗中得到了认可。但是,传统放疗仍存在一定的缺陷,如高剂量射线对正常组织产生的毒性以及肿瘤微环境对放疗过程中的毒性物质产生抑制作用,都限制了放疗的效果。针对以上不足之处,研究团队开发了一种富氧X射线纳米倍增器:Hb@Hf-Ce6纳米粒子。该纳米放疗倍增器将氧气直接加载深度肿瘤组织中,在调和深度肿瘤乏氧环境的前提下提高肿瘤细胞对放疗的敏感度;同时金属多酚配位的结构将重金属离子引入到放疗的过程中,深层次强化了放疗的治疗效果,达到二次倍增肿瘤致死的目的。另外,PD-1抗体蛋白的引入能够有效对远端瘤以及肿瘤细胞的肺转移产生抑制作用。
Hb@Hf-Ce6纳米粒子基于金属多酚配位的结构,将所有功能分子集成到纳米粒子中,实现多功能抗肿瘤效果。二氢卟酚e6(Ce6)修饰的多酚结构与高原子序数放疗增敏剂(铪,Hf)配位,氧载体血红蛋白(Hb)嵌合于配位结构中,克服与缺氧相关的耐辐射性。具体而言,在X射线辐射下,由Hf激发的放射诱导的物理过程可以启动光敏剂Ce6,从而产生高水准ROS诱导癌细胞损伤。
在体外乳腺癌4T1细胞实验中,结果表明Hb@Hf-Ce6纳米粒子提高了放疗和放动力治疗诱导的肿瘤细胞死亡。此外,在小鼠原位双边种瘤模型中,免疫检查点抑制剂的引入提高了放疗和放动力治疗引起的免疫反应,从而实现高效长时抑制肿瘤生长和转移。因此,这种联合治疗策略诱导了针对癌症根除和转移抑制的全面抗肿瘤免疫应答。本研究提出了一种多功能金属多酚纳米平台,可与免疫疗法相结合,实现高效的X射线介导的放射治疗——放动力治疗,为癌症治疗提供新的治疗选择。
论文《富氧金属多酚X射线纳米倍增器,用于癌症放疗,放动力治疗和免疫治疗》的共同第一作者为博士生桑玮及博士后研究员谢丽斯,代云路为通讯作者。健康科学学院院长邓初夏,博士后研究员李蓓和李杰,博士生王国浩、张展和郭森亦作出重要贡献。此项研究由澳门特别行政区科学技术发展基金(文件编号:0109/2018/A3 和0011/2019/AKP)及澳门大学(文件编号:SRG2018-00130-FHS)资助。文章全文可浏览:https://onlinelibrary.wiley.com/doi/10.1002/advs.202003338